Advanced solution inThermodynamics

Thermodynamic Datenbase und Process Design
|
Advanced solution inThermodynamics |
|
 |
|
|
Thermodynamic Datenbase und Process Design |
Thermodynamische Berechnungen und Prozessmodellierung
Inhalt
1. Berechnung eines Gleichgewichtszustands in AsTher
2. Antwort auf die Fragen, ob und wie ein Prozess
mithilfe thermodynamischer Berechnungen modelliert oder dargestellt werden kann.
Beispiele und Erläuterungen
Beispiel: Erstellung eines Prozesskonzepts
und Prozessanalyse mithilfe thermodynamischer Berechnungen und
Messungen
Bestimmung der
substanziellen Zusammensetzung eines Einsatzmaterials mithilfe thermodynamischer
Berechnungen
1.. Berechnung eines
Gleichgewichtszustands
Ausgangszustand für die Berechnung eines Gleichgewichtszustands ist ein
hypothetisches Gemisch der ausgewählten Substanzen in allen Aggregatzuständen:
Gas, Flüssigkeit, Feststoff und Plasma.
Die Lagrange-Koeffizienten der Elemente im Gleichgewichtszustand werden iterativ
entsprechend den Phasen bestimmt,
so dass die elementare Zusammensetzung der Produkte der
elementaren Zusammensetzung der eingesetzten
Substanzen entspricht. .
Die Erweiterte Option "Turbulent System: Heigh Entropy"
kann ausgewählt werden in den Anwendungen
Equilibrium (Equlibrm.exe) and
Process Calculator (XProCalc.exe)
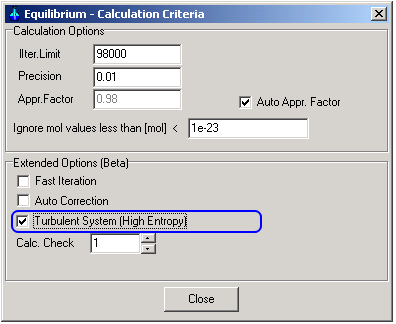
1.1. Bei Auswahl der Berechnungsoption „Maximale Entropie“ Turbulentsystem
Die Berechnung ist abgeschlossen,
wenn der vorgegebene Druck in der Gasphase erreicht ist
oder wenn die chemische Potential von Substanzen
in einer Phase dem Systemdruck entspricht.
Die Summe der chemischen Aktivitäten der Substanzen kann nicht in jeder Phase gleich 1 sein, Σ ai ≠ 1.
Der Berechnungsalgorithmus "Maximale Entropie"
hat jedoch keinen Einfluss auf die Berechnungsergebnisse:
1.1.1. wenn das Reaktionssystem nur aus einer Phase besteht.
1.1.2. wenn das Reaktionssystem aus Gas- und
Feststoffphasen besteht,
während die Feststoffe nur als Reinstoffe vorliegen,
z. B. bei der Verbrennung
von Holz, Kohle oder Pyrolyse von Feststoffen.
1.2. Bei Nichtauswahl der Berechnungsoption „Maximale Entropie“
wird die Berechnung abgeschlossen, wenn die Summe der chemischen
Aktivität bzw. Fugazität von
Substanzen in allen Phasen dem Systemdruck entspricht.
Die Summe der chemischen Aktivitäten der Stoffe für jede Phase: Σ
ai ≈ 1
In einigen Fällen kann die Summe der Aktivität oder Fugazität in einer Phase
nicht dem Systemdruck entsprechen.
In diesem Fall zeigt die Anwendung möglicherweise eine Meldung, oder der Grund
ist aus den Berechnungsergebnissen ersichtlich.
1.3. In beiden obigen Fällen der Berechnungsoptionen
für alle möglichen Reaktionen
wie z.B. a A + b B = c C + d D
gelten die folgenden Gleichungen unabhängig von der ausgewählten Berechnungsoption:
K=( [A]a . [B]b)/( [C]c . [D]d) = exp(-ΔG°/R T)
[A], [B], [C], [D]: Aktivität oder Fugazität von Substanzen im Gleichgewichtszustand
ΔG° = c G°C + d G°D - a G°A
- b G°B
G°i(T,P) [J/mol]: Die molare freie Energie der
reinen Substanz i bei Temperatur T
und
c GC + d GD
= a GA
+ b GB
Gi(T,P) = G°i(T,P)
+ R T ln ai
Gi(T,P) [J/mol]: Die molare freie Energie der Substanz i im Gleichgewichtszustand bei Temperatur T und Druck P
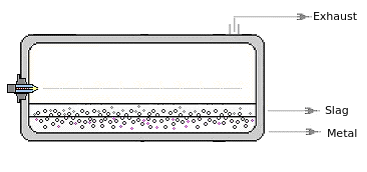
1.4. Turbulente Reaktoren| Bei der
thermodynamischen Modellierung von Hochtemperaturreaktoren mit mehreren
flüssigen Phasen erreichen wir durch die Wahl des Algorithmus „Maximale
Entropie“ eine nahezu exakte Abbildung der Prozesse. Infolge hoher
Turbulenz können Flüssigkeit, Feststoffpartikel und Gasblasen kurzzeitig in
anderen Phasen vorliegen (z. B. flüssige Metalle, dispergiert in
der Schlacke
oder Aerosol, Metalle, dispergiert in der Schlacke). |
 |
2. Antwort auf die Fragen, ob und wie ein Prozess mithilfe thermodynamischer Berechnungen modelliert oder dargestellt werden kann.
Bei der Erstellung des thermodynamischen Modells
von Prozessesen sind unter
anderem die folgenden Umständen zu berücksichtigen:
2.1. Reaktionen sind möglich.
Beispiel: Trifft ein O2 -Molekül bei 800 °C auf ein CH4-Molekül,
reagiert es sofort, da die Zündtemperatur von CH4 überschritten wird.
Das Ausmaß der Reaktion zwischen O2 und CH4 wird durch
die Naturgesetze und die Thermodynamik bestimmt.
O2 reagiert bei 800 °C auch sofort mit C, CO, CH3OH, CH4 und
mehreren anderen Stoffen.
Der Abkühlungsprozess von Abgasen unter 500 °C ist selbst in einem optimierten
Reaktor schwer zu berechnen,
da die Zündtemperatur mehrerer Stoffe, darunter CH4,
H2 und CO,
unterschritten wird.
Wenn keine Reaktion stattfinden kann, sind thermodynamische Berechnungen nur
bedingt hilfreich.
2.2. Strömungen, Turbulenzen und Geometrie – ausreichende Durchmischung ist
gewährleistet.
Es hängt davon ab, wie schnell ein O2-Molekül z. B. auf ein CH4
-Molekül trifft.
Wichtige Faktoren sind die Turbulenz (Reynolds-Zahl) und die Geometrie des Reaktors.
2.3. Die angenommene Temperatur ist annähernd überall im Reaktor gleich.
In einem Reaktor mit optimierter Strömung und annähernd gleichmäßiger lokaler
Temperatur kann die Produktzusammensetzung thermodynamisch mit ausreichender
Genauigkeit berechnet werden.
2.4. Flüssige Metalloxide reagieren oft nicht
mit CO(g), CH4(g) oder H2(g) .
Der Grund, warum flüssige Metalloxide nicht mit Substanzen im gasförmigen oder
festen Zustand reagieren, liegt oft unter anderem an der Oberflächenspannung
oder dem Aktivitätskoeffizienten von MeOx an der
Oberfläche.
Basierend auf Messungen können die Aktivitätskoeffizienten von MeOx
mithilfe thermodynamischer Berechnungen ermittelt werden.
2.5 Kohlenstoff in der reinen festen Phase reagiert nicht direkt mit
flüssigen Metalloxiden (FeO(l) im Hochofen).
Kohlenstoff reagiert nur mit FeO(l), wenn Kohlenstoff in der
Schlacke durch Zugabe von CaO und SiO2
gelöst wird.
Das chemische Potential von gelöstem Kohlenstoff in Schlacken kann anhand des
chemischen Potentials von CO, CO2 oder O2 in der Gasphase
ermittelt werden.
2.6. Thermodynamische Berechnungen helfen zu bestimmen, welche
Produktzusammensetzung sich bilden kann,
wenn beispielsweise eine bestimmte Menge O2 mit dem Eingangsmaterial
reagiert.
Durch den Vergleich der berechneten und gemessenen Zusammensetzung der Produkte
bestimmen wir, welcher O2-Anteil im Reaktor reagiert und wie hoch der
Anteil der Leckluft ist.
2.7. Zuverlässige Wärme- und Massenbilanz mithilfe thermodynamischer
Berechnungen
Die Wärme- und Massenbilanz eines Prozesses erfordert die substanzielle
Zusammensetzung der Einsatz-Materialien
und Produkte.
Oftmals liegt nur die elementare Zusammensetzung eines
Einsatz-Materials,
der Rückstände aus anderen Prozessen und/oder
der natürlichen Erze vor.
Thermodynamische Berechnungen ermöglichen eine zuverlässige
Bestimmung der substanziellen Zusammensetzung eines Einsatz-Materials.
Wie solche Berechnungen zuverlässig durchgeführt werden, wird in „DeterminationOfSubstantialComposition.DE.pdf“
erläutert.
2.8. Prozessanalyse und Störfallprävention
Thermodynamische Berechnungen ermöglichen eine zuverlässige Prozessanalyse.
Wir erhalten Informationen über das Verhalten umweltrelevanter
Substanzen und Elemente (z. B. As, Cd, Cl, Hg, Sb, Tl) in Abhängigkeit
von den Prozessbedingungen und von
den Begleit-Substanzen (z. B. BaO, MgO, SiO, FeO) im
Eingangsmaterial.
Wir können mehrere Störfälle durch unerwünschte
Substanzen in einer Phase basierend auf
der thermodynamischen Berechnungen vermeiden,
z. B. Substanzen mit den Elementen Cl, Cd, Hg, S, Tl im
Abgas oder Substanzen mit den Elementen Tl, S in einer
Metallphase.